Desfechos finais do estudo randomizado de fase 3 IMvigor130 descrevem a sobrevida global do atezolizumabe + platina/gencitabina de primeira linha de carcinoma urotelial localmente avançado ou metastático

O tratamento de primeira linha em pacientes com câncer urotelial metastático com o atezolizumabe + platina/gencitabina demonstrou ter uma sobrevida global melhorada quando comparado ao placebo + platina/gencitabina, entretanto não atingiu significância estatística.
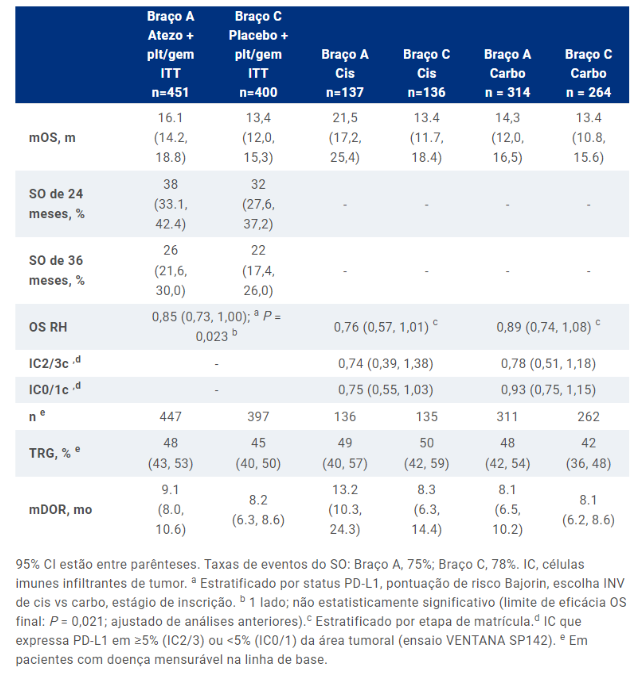
Corroborando com dados exploratórios anteriores, os resultados atualizados do estudo de fase 3 IMvigor130 mostrou que atezolizumabe + platina/gencitabina tem uma sobrevida global maior quando os pts receberam cisplatina quando comparado a carboplatina.
O câncer urotelial é uma malignidade agressiva associada a mais de 100 mil mortes globais anualmente e uma sobrevida de 5 anos de cerca de 5% no cenário metastático. O tratamento com quimioterapia baseada em cisplatina como tratamento de primeira linha é o padrão de tratamento desde 1980 e oferece benefício de sobrevida global. No entanto, 40-50% dos pacientes com carcinoma urotelial metastático (mUC) são inelegíveis para cisplatina devido ao mau desempenho, comorbidades ou função renal prejudicada, e esses pacientes geralmente recebem regimes à base de carboplatina, uma opção inferior.
Os inibidores de ligante de morte programada 1 (PD-L1) e morte programada 1 (PD-1) são as primeiras novas terapias sistêmicas para carcinoma urotelial metastático, tanto para tratamento de primeira linha de pacientes inelegíveis para cisplatina quanto para pacientes com progressão da doença apesar da platina baseada em quimioterapia. Regimes que combinam quimioterapia à base de platina e inibidores de PD-L1 e PD-1 são atraentes pois a quimioterapia à base de platina pode induzir efeitos imunomoduladores, aumentando assim o bloqueio concomitante de PD-L1 e PD-1. Essa combinação também pode ser benéfica devido à ausência de resistência clínica cruzada entre essas classes terapêuticas, pois uma minoria de pacientes recebe tratamento além da terapia de primeira linha.
IMvigor130 é o primeiro estudo randomizado de fase 3 a relatar resultados para quimioterapia baseada em platina mais bloqueio PD-L1 ou PD-1, ou bloqueio PD-L1 sozinho ou bloqueio PD-1 sozinho, versus quimioterapia padrão baseada em platina mais placebo como tratamento de primeira linha para carcinoma urotelial metastático. A análise primária do IMvigor130 demonstrou benefício de sobrevida livre de progressão (SLP) estatisticamente significativo com tratamento de primeira linha (1L) com o anticorpo monoclonal anti-PD-L1 atezolizumabe (atezo) associado com platina/gencitabina (plt/gem) (Grupo A) versus placebo +plt/gem (Grupo C) em pacientes com mUC. Os dados provisórios mostraram melhor sobrevida global (SG) com o braço A vs C, mas não ultrapassaram o limite pré-especificado para significância. Em análises exploratórias, o SG melhorou quando atezo foi combinado com cisplatina (cis) versus carboplatina (carbo), independentemente do status de PD-L1.
Durante o ASCO GU Cancers Symposium desse ano, Matt D. Galsky apresentou os dados finais do sistema operacional dos braços A e C. Os pacientes (pts) que participaram do estudo foram designados aleatoriamente 1:1:1 para o braço A, B (atezo sozinho) ou C. Os pacientes dos braços A e C receberam cis ou carbo por escolha do investigador (INV). Os endpoints co-primários foram SLP por INV RECIST 1.1 e SG (Braços A vs C) e SG (Braços B vs C), testados hierarquicamente. Segurança, taxa de resposta objetica (ORR) e duração da resposta (DOR), taxa de controle da doença (DCR; respota completa [CR] confirmado, resposta parcial [PR] ou [SD ≥ 6 meses]) e dados SG exploratórios pré-especificados também são relatados.
A partir do corte de dados em 31 de agosto de 2022 (49 meses desde o último pt atribuído aleatoriamente), em pts ITT (análise de intenção de tratar), o benefício SG não foi estatisticamente significativo; no subgrupo cis, HR foi de 0,76 (IC95% 0,57 – 1,01; Tabela). Em pts ITT, DCR foi de 65% (290/447) no Braço A e 60% (239/397) no Braço C. 81% de pts avaliáveis de segurança (370/454) no Braço A e 80% (312/389) no Braço C teve um efeito adverso (EA) relacionado ao tratamento Gr 3/4 (TRAE). Gr 5 TRAEs ocorreram em 9 pts (2%) no Braço A e 4 (1%) no Braço C; EAs Gr 3/4 de interesse especial foram vistos em 41 pts (9%) no Braço A e 17 (4%) no Braço C.
Os autores concluem que nesta análise final, SG melhorada com atezo+plt/gem vs placebo+plt/gem não atingiu significância estatística em pts ITT com mUC. Como visto com dados exploratórios anteriores, a SG melhorada com atezo+plt/gem foi maior quando os pts receberam cis vs carbo. Nenhum novo sinal de segurança foi visto.
Referências:
1 – GALSKY, M. D. et al., Atezolizumab (atezo) + platinum/gemcitabine (plt/gem) vs placebo + plt/gem for first-line (1L) treatment (tx) of locally advanced or metastatic urothelial carcinoma (mUC): Final OS from the randomized Phase 3 IMvigor130 study. J Clin Oncol 41, 2023 (suppl 6; abstr LBA440)
2 – GALSKY, Matthew D. et al. Atezolizumab with or without chemotherapy in metastatic urothelial cancer (IMvigor130): a multicentre, randomised, placebo-controlled phase 3 trial. The Lancet, v. 395, n. 10236, p. 1547-1557, 2020.
© 2020 Oncologia Brasil
A Oncologia Brasil é uma empresa do Grupo MDHealth. Não provemos prescrições, consultas ou conselhos médicos, assim como não realizamos diagnósticos ou
tratamentos.


 Vea MedIQ en Español
Vea MedIQ en Español 




