Resultados da expansão da dose do BCA101 com pembrolizumabe em pacientes com carcinoma de células escamosas de cabeça e pescoço recorrente e metastático
A associação do inibidor bifuncional de EGFR/TGFβ BCA101 com pembrolizumabe mostra atividade antitumoral encorajadora em pacientes com câncer de células escamosas de cabeça e pescoço recorrente e metastático
Durante o encontro anual da American Society of Clinical Oncology – ASCO 2023® que está sendo realizado no mês de junho, Glenn J. Hanna apresentou os dados do estudo aberto de fase I/Ib com o anticorpo BCA 101 associado com pembrolizumabe (anticorpo monoclonal anti-PD1) como tratamento para carcinoma de células escamosas de cabeça e pescoço (CCECP) recorrente e metastático (R/M) (NCT04429542). O BCA 101 é um anticorpo EGFR bifuncional de primeira classe fundido a uma carga útil de modulação imune de TGFβ que em resultados anteriores demonstrou ser bem tolerado e clinicamente ativo como agente único de tratamento e em combinação com o bloqueio PD-1 (pembrolizumabe).
O estudo teve uma coorte contínua de expansão de dose multicêntrica aberta e de braço único com pacientes com CCECP R/M com um tumor PD-L1 CPS≥1 sem terapia sistêmica anterior para doença R/M, ECOG 0-1 e doença mensurável (RECIST v1.1). Os pacientes receberam BCA101 (1500 mg intravenoso nos dias 1, 8, 15) com pembrolizumabe (200 mg intravenoso no dia 1) a cada 21 dias. O endpoint primário avaliado foi a segurança e os endpoints secundários foram a taxa de resposta global (ORR), duração da resposta (DOR), sobrevivência livre de progressão (SLP) e sobrevivência global (SG). Os resultados exploratórios foram a avaliação dos preditores moleculares e imunológicos de resposta. Um projeto ideal de dois estágios de Simon foi empregado: entre 18 pacientes avaliáveis no estágio 1, > 3 pacientes em resposta desencadeou a continuação para o estágio 2 registrando 21 pacientes adicionais visando uma ORR > 35%.
De fevereiro de 2022 a janeiro de 2023, 20 pacientes foram inscritos no estudo enquanto 18 eram avaliáveis (tiveram primeiros exames de reestadiamento) no estágio 1. Os pacientes eram mais frequentemente homens (n = 13, 65%) com idade média de 66 (intervalo: 31- 77). Os subsítios primarios de CCECP mais comuns foram: Orofaringe (10, 50%) [7/10 (70%) foram HPV/p16-pos] e cavidade oral (n=7, 35%). Quinze pts (75%) tinham doença metastática distante. A ORR no estágio 1 foi de 44% (8 PRs, 4 SD) com uma taxa de benefício clínico (CBR=PR+SD) de 67%; 7/12 (58%) pts HPV-neg obtiveram uma resposta. O DOR médio não foi alcançado, mas o tempo médio de tratamento foi de 6,7 meses (intervalo: 2,7 – 11,0+) entre os respondedores. Dez pacientes descontinuaram a terapia; todos menos 1 para PD (n=1 para toxicidade). Eventos adversos relacionados ao tratamento de grau 3+ (TRAEs) foram observados em 4 pacientes (20%, mais comum: anemia). Não foram observadas mortes relacionadas com o tratamento. A erupção cutânea acneiforme foi o TRAE mais comum de qualquer grau (n=15, 75%). As estimativas de SLP e SG estão disponíveis. Oito (44%) tiveram pontuações iniciais de PD-L1 CPS de 0-19, enquanto dez (56%) foram ≥20. O estágio 2 está se inscrevendo ativamente com a conclusão do acúmulo esperado pela reunião.
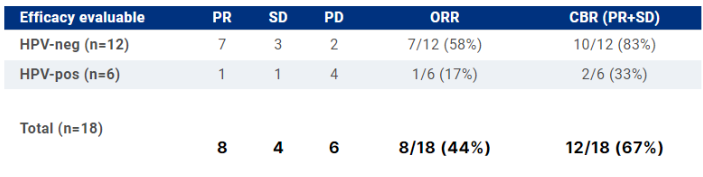
Os autores concluem que os resultados do estágio 1 dessa coorte de expansão mostraram que BCA101 associado com pembrolizumabe mostra uma atividade antitumoral encorajadora com potencial aditivo, particularmente entre pts de HPV-neg; e a combinação é bem tolerada entre está população com CCECP R/M.
Referência:
1 – HANNA, G. J. et al., Dose expansion results of the bifunctional EGFR/TGFβ inhibitor BCA101 with pembrolizumab in patients with recurrent, metastatic head and neck squamous cell carcinoma. J Clin Oncol 41, 2023 (suppl 16; abstr 6005).
© 2020 Oncologia Brasil
A Oncologia Brasil é uma empresa do Grupo MDHealth. Não provemos prescrições, consultas ou conselhos médicos, assim como não realizamos diagnósticos ou
tratamentos.


 Vea MedIQ en Español
Vea MedIQ en Español 




