FDA aprova primeira terapia gênica para uso clínico em neoplasias hematológicas
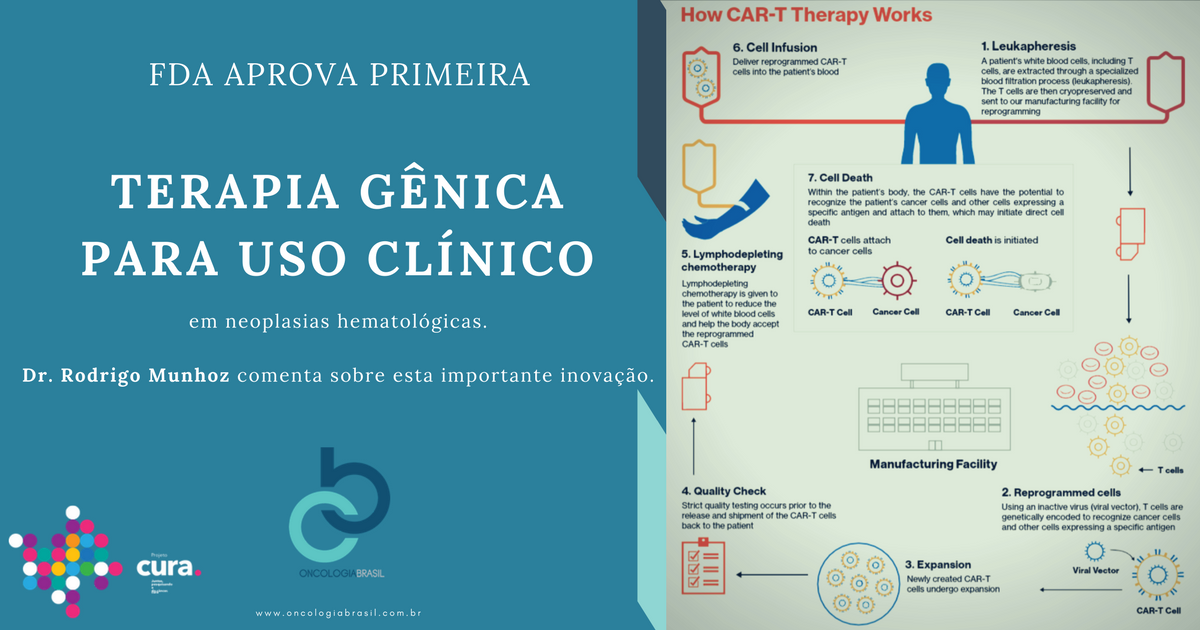

No dia 30 de agosto de 2017 o Food and Drug Administration (FDA) Norte-Americano aprovou o agente Kymriah (tisagenlecleucel) para uso como terapia celular adotiva para pacientes com leucemia linfoide aguda refratária.
O tisagenlecleucel é uma forma de imunoterapia (CAR-T cell) concebido a partir de técnicas de bioengenharia de linfócitos T autólogos, geneticamente modificados para reconhecer alvos específicos através de receptores de antígenos modificados (Chimeric Antigen Receptors – CAR).
Trata-se da primeira aprovação dessa classe de agentes, capazes de alterar drasticamente o tratamento de tumores hematológicos e, talvez em um futuro próximo, também tumores sólidos.
Dr. Rodrigo Munhoz é Médico Oncologista do Centro de Oncologia – Hospital Sírio Libanês e do ICESP – Instituto do Câncer do Estado de São Paulo. Além de Coordenador – Programa de Residência Médica em Oncologia Clínica – Hospital Sírio Libanês.
© 2020 Oncologia Brasil
A Oncologia Brasil é uma empresa do Grupo MDHealth. Não provemos prescrições, consultas ou conselhos médicos, assim como não realizamos diagnósticos ou
tratamentos.


 Vea MedIQ en Español
Vea MedIQ en Español