A-BRAVE: Um ensaio randomizado de fase III com avelumabe em câncer de mama triplo-negativo inicial com doença residual após quimioterapia neoadjuvante ou de alto risco após cirurgia primária e quimioterapia adjuvante
Neste estudo, os autores apresentam resultados do estudo A-BRAVE, um estudo adjuvante de fase III, multicêntrico e randomizado que avaliou a eficácia do avelumabe, um anticorpo anti PD-L1 como tratamento adjuvante para pacientes com câncer de mama triplo negativo precoce de alto risco
O prognóstico de pacientes com câncer de mama triplo negativo precoce (em inglês, early triple negative breast cancer – TNBC) ainda é ruim e novos tratamentos eficazes são necessários. O TNBC é o subtipo de câncer de mama mais imunogênico e isso pode ser responsável pela sensibilidade aos inibidores do ponto de controle imunológico. Aqui, os autores apresentam resultados do A-BRAVE, um estudo adjuvante de fase III, multicêntrico e randomizado que avaliou a eficácia do avelumabe, um anticorpo anti PD-L1 como tratamento adjuvante para pacientes com TNBC precoce de alto risco.
No presente estudo, os pacientes foram incluídos após completarem o tratamento padrão com intenção curativa, incluindo cirurgia e quimioterapia neoadjuvante/adjuvante. Foram definidos como alto risco: i) doença residual invasiva (mama e/ou nódulos) após quimioterapia neoadjuvante (estrato A); ii) >pN2/qualquer pT, pN1/pT2 ou pN0/pT3 após cirurgia primária (estrato B). Os pacientes foram distribuídos aleatoriamente (1:1, balanceado para os estratos A e B) para Avelumabe (10 mg/kg, IV) a cada duas semanas por 1 ano ou observação. Os desfechos coprimários foram sobrevida livre de doença (SLD) na população total e no estrato A. Foram necessários 474 pontos para detectar, na população total, uma melhora de 60% para 73,6% na taxa de sobrevida livre de progressão (SLP) em 3 anos (HR 0,6; 90 % de potência, teste unilateral, alfa 2%). Foram necessários 172 eventos de SLD para realizar a análise orientada a eventos. Assumindo uma proporção de 70-80% dos pacientes inscritos no estrato A, o poder esperado para detectar um HR 0,6 no alfa alocado neste subgrupo é de 70-79%. A sobrevida global (SG) foi um desfecho secundário.
477 pacientes foram distribuídos aleatoriamente em 64 centros italianos e 6 no Reino Unido entre o período que compreendeu de junho/2016 a outubro/2020. 11 pacientes (3 no grupo avelumabe e 8 no grupo controle) retiraram o consentimento imediatamente após a randomização e foram excluídos de análises posteriores. 378 pacientes entraram no Estrato A (83%), dos quais 99 (57 no grupo avelumabe e 42 no grupo controles) receberam quimioterapia adicional após a cirurgia antes da inscrição no estudo. Os resultados de eficácia para os dois pontos finais coprimários da SLD e os pontos finais secundários do sistema operacional são relatados na tabela abaixo.
Tabela 1: Resultados da sobrevida dos grupos Avelumabe e controle na população total e no estrato A.
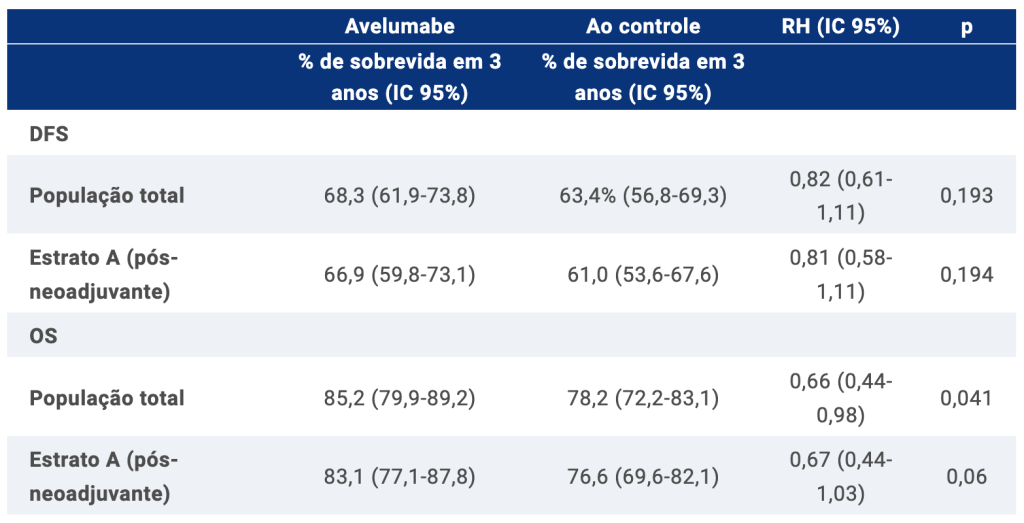
Em conclusão, os resultados evidenciaram que um ano de avelumabe adjuvante vs. controle não melhora significativamente a SLD em pacientes com TNBC de alto risco. No entanto, a SG foi significativamente melhorada com avelumabe vs. controle. Adicionalmente, os autores apontam que discutiram no ASCO 2024 sobre a sobrevivência livre de recorrência e sobrevivência livre de metástases à distância. Informações sobre ensaios clínicos: NCT02926196.
Referências:
- Pier Franco Conte, Maria Vittoria Dieci, Giancarlo Bisagni et al. A-BRAVE trial: A phase III randomized trial with avelumab in early triple-negative breast cancer with residual disease after neoadjuvant chemotherapy or at high risk after primary surgery and adjuvant chemotherapy. J Clin Oncol 42, 2024 (suppl 17; abstr LBA500). 10.1200/JCO.2024.42.17_suppl.LBA500. Disponível em: https://meetings.asco.org/abstracts-presentations/232429. Acessado em: 03/06/2024.
© 2020 Oncologia Brasil
A Oncologia Brasil é uma empresa do Grupo MDHealth. Não provemos prescrições, consultas ou conselhos médicos, assim como não realizamos diagnósticos ou
tratamentos.


 Vea MedIQ en Español
Vea MedIQ en Español