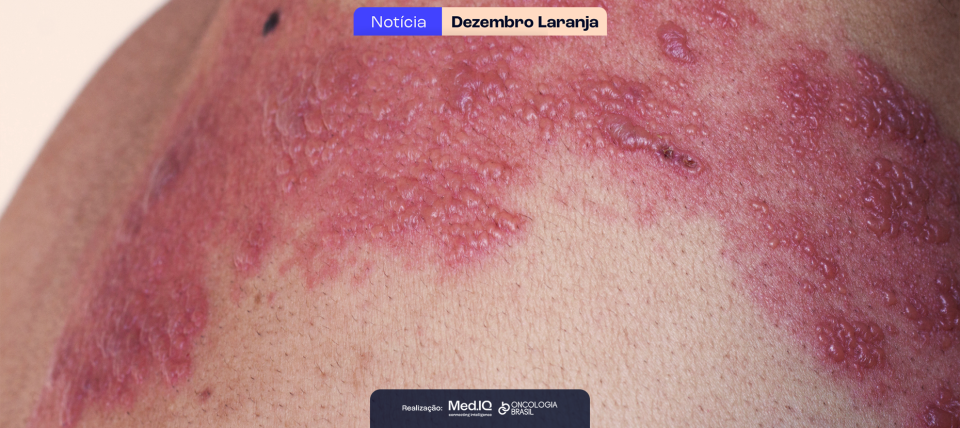
Cemiplimabe como alternativa de tratamento para carcinoma basocelular localmente avançado

Estudo de fase 2, apresentado no Congresso da European Association of Dermato-Oncology (EADO) de 2022, acompanha os benefícios clínicos e segurança do cemiplimabe no tratamento de pacientes com carcinoma basocelular localmente avançado. Este trabalho apresenta os dados de seguimento de 40 meses
Em 2021, a Anvisa aprovou o uso de cemiplimabe, um anticorpo monoclonal que bloqueia a via PD-1/PD-L1, como recurso terapêutico para o carcinoma basocelular localmente avançado (cBLA). Para este tipo de câncer, as terapias alvo com inibidores da via hedhog são uma alternativa de tratamento, e apesar de amplamente utilizados, alguns pacientes presentam intolerância, ou simplesmente não apresentam melhora do quadro clínico após alguns meses.
Em sua primeira fase, o estudo teve como foco pacientes com cBLA que suspenderam o uso de inibidores da via hedgehog, e demonstrou em análise primária que cemiplimabe é seguro e apresenta grande benefício clínico. Agora, em sua segunda fase, os pacientes foram acompanhados a longo prazo e novas conclusões foram estabelecidas.
Durante uma mediana de 15,9 meses oitenta e quatro pacientes inscritos foram acompanhados, os mesmos receberam de forma intravenosa cemiplimabe 350mg, a cada 3 semanas, durante 93 semanas ou até a progressão da doença. Dentre os resultados relevantes estavam principalmente aqueles relacionados a resposta dos participantes ao uso da medicação. A taxa de resposta objetiva por revisão central independente (RCI) foi de 32%, sendo 6 respostas completas e 21 parciais, e nos pacientes que responderam, o tempo médio da resposta foi de 4,3 meses. A duração da resposta também foi avaliada, no entanto a mediana não foi alcançada. A continuidade da resposta também foi avaliada e se mostrou relevante, com uma proporção estimada de 56,6% durante dois anos.
Outros desfechos avaliados pelos pesquisadores foram as sobrevidas dos pacientes, sendo que a mediana de sobrevida livre de progressão foi de 16,5 meses, enquanto a mediana de sobrevida global não foi alcançada. Um outro desfecho avaliado foi a taxa de controle da doença (resposta completa/ resposta parcial e doença estável) e a mesma foi de 79.8% por RCI. Apesar de não terem sido registradas mortes, houve efeitos adversos como fadiga (31,0%), diarreia (23,8%), prurido (21,4%), astenia (20,2%) e artralgia (19,0%). Também foi registrada a interrupção do tratamento por parte de 17,9% dos integrantes, devido a efeitos adversos de grau 3.
Dessa forma, por meio dessa nova fase foi possível concluir que o tratamento de cBLA com cemiplimabe é seguro e eficaz, independentemente do uso da terapia com inibidores da via hedhog. Além disso, tornou-se claro que estender o tratamento por longo prazo aumenta a eficácia e a durabilidade da resposta.
Referências
- Stratigos Alexander, et al. Phase 2 study of cemiplimab in patients with locally advanced basal cell carcinoma after hedgehog inhibitor therapy: Long-term follow-up. Non-Melanoma Skin Cancer diagnosis & treatment I (BCC & SCC) Id. 29 .EADO -European Associantion of dermato oncology – 18 th Congress.
© 2020 Oncologia Brasil
A Oncologia Brasil é uma empresa do Grupo MDHealth. Não provemos prescrições, consultas ou conselhos médicos, assim como não realizamos diagnósticos ou
tratamentos.


 Vea MedIQ en Español
Vea MedIQ en Español