Larotrectinibe: uma nova terapia alvo para tumores com fusões de NTRK

A família de receptores de tropomiosina quinase, TRK-A, B e C, é codificada por três genes distintos, NTRK1, 2 e 3[1]. Após a embriogênese, as proteínas TRK são principalmente restritas ao sistema nervoso e funcionam durante o desenvolvimento e manutenção neuronal normal, com o papel de regular atividades fisiológicas como termorregulação, dor, movimento, memória, peso corporal e propriocepção[2, 3]. As fusões de NTRK são anormalidades genéticas que ocorrem quando um dos genes (NTRK1, NTRK2, NTRK3) se liga anormalmente a outro gene não relacionado, tais como ETV6, LMNA, TPM3, dentre outros. Essa anormalidade resulta em sinalização descontrolada da via do TRK e que pode levar a diversos tipos de câncer tanto em adultos como em crianças (figura 1). De modo geral, as fusões de NTRK são mutuamente exclusivas com outras alterações genômicas ativadoras, tais como EGFR, ALK ou BRAF[4], e são bastante raras – estimam-se 1500 a 5000 novos casos por ano de tumores com fusão de NTRK nos EUA[5].
Tais eventos de fusão com o domínio quinase dos genes NTRK1, 2 e 3 com inúmeros parceiros torna o diagnóstico destas alterações oncogênicas bastante desafiador. Vários métodos diagnósticos podem detectar direta ou indiretamente as fusões de NTRK, tais como: RT-PCR (real time polymerase chain reaction), FISH (fluorescence in situ hybridization), NGS (next generation sequencing) e IHQ (imuno-histoquímica). A IHQ tem sensibilidade acima de 95% e pode ser utilizada como ferramenta de rastreamento, enquanto que o NGS de RNA é apontado como o método confirmatório de eleição[6, 7].
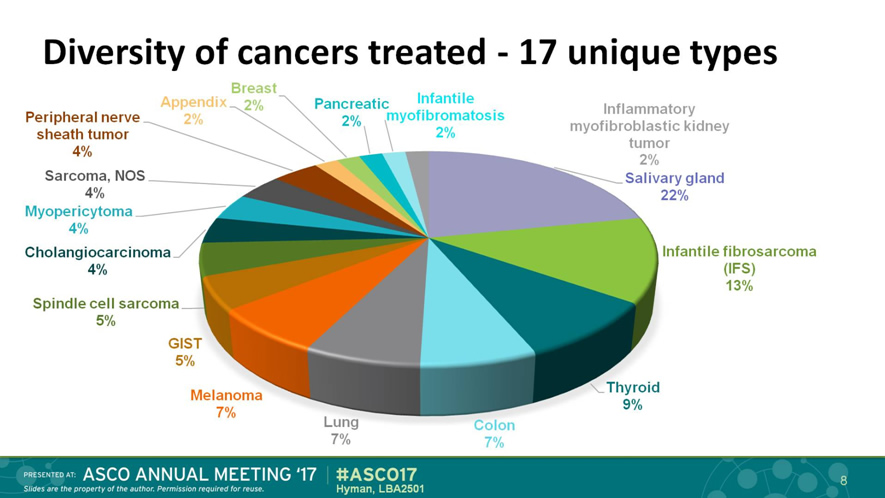
O larotrectinib é um inibidor oral pan-TRK altamente seletivo. Estudos iniciais avaliaram a eficácia desta droga em 17 tipos de tumores pediátricos e de adultos (figura 2)[5]. A análise conjunta de 3 estudos de fase I e II demonstrou altíssima eficácia do larotrectinib, com taxa de resposta objetiva de 81%, respostas duradouras e indícios de atividade em metástases no sistema nervoso central, tanto em adultos como em crianças, e independente do tipo de fusão e do tipo de tumor. Com seguimento mediano de 17,6 meses, a sobrevida livre de progressão mediana ainda não foi atingida. O perfil de toxicidade se mostrou extremamente favorável, com 93% dos eventos adversos ocorrendo em graus 1 ou 2[5, 8, 9].
Com base nestes dados, o FDA (Food and Drug Administration) concedeu, em 26 de novembro de 2018, a aprovação acelerada ao larotrectinib para pacientes adultos e pediátricos com tumores sólidos com fusão NTRK metastáticos ou naqueles em que a ressecção cirúrgica pode resultar em morbidade grave. Trata-se de uma aprovação agnóstica, ou seja, independente do tipo de tumor primário, com base apenas na característica molecular[10]. Há grande expectativa para aprovação pelas agências regulatórias de outros países, como o Brasil, uma vez que o larotrectinib representa um grande avanço da medicina personalizada, por ser uma ferramenta altamente eficaz para tratamento de doenças raras, porém com opções limitadas de tratamento até então.

Referências:
- Vaishnavi, A., A.T. Le, and R.C. Doebele, TRKing down an old oncogene in a new era of targeted therapy. Cancer Discov, 2015. 5(1): p. 25-34.
- Doebele, R.C., et al., An Oncogenic NTRK Fusion in a Patient with Soft-Tissue Sarcoma with Response to the Tropomyosin-Related Kinase Inhibitor LOXO-101. Cancer Discov, 2015. 5(10): p. 1049-57.
- Amatu, A., A. Sartore-Bianchi, and S. Siena, NTRK gene fusions as novel targets of cancer therapy across multiple tumour types. ESMO Open, 2016. 1(2): p. e000023.
- Stransky, N., et al., The landscape of kinase fusions in cancer. Nat Commun, 2014. 5: p. 4846.
- Drilon, A., et al., Efficacy of Larotrectinib in TRK Fusion-Positive Cancers in Adults and Children. N Engl J Med, 2018. 378(8): p. 731-739.
- Gatalica, Z., et al., Molecular characterization of cancers with NTRK gene fusions. Mod Pathol, 2018.
- Hechtman, J.F., et al., Pan-Trk Immunohistochemistry Is an Efficient and Reliable Screen for the Detection of NTRK Fusions. Am J Surg Pathol, 2017. 41(11): p. 1547-1551.
- Lassen U, A.C., Kummar S, et al, Larotrectinib efficacy and safety in TRK fusion cancer: an expanded clinical dataset showing consistency in an age and tumor agnostic approach. Ann Oncol, 2018. 29(Suppl8): p. Abstract 409O. Presented at: 2018 ESMO Congress; October 19-23, 2018; Munich, Germany.
- David Michael Hyman, T.W.L., Shivaani Kummar, Steven G. DuBois, Anna F. Farago, Alberto S. Pappo, George D. Demetri, Wafik S. El-Deiry, Ulrik Niels Lassen, Afshin Dowlati, Marcia S. Brose, Valentina Boni, Brian Turpin, Ramamoorthy Nagasubramanian, Scott Cruickshank, Michael Craig Cox, Nora C. Ku, Douglas S. Hawkins, David S. Hong, Alexander E. Drilon, The efficacy of larotrectinib (LOXO-101), a selective tropomyosin receptor kinase (TRK) inhibitor, in adult and pediatric TRK fusion cancers. J Clin Oncol, 2017. 35(suppl; ): p. abstr LBA2501. Presente at ASCO Annual Meeting 2017.
- Approved Drug Products with Therapeutic Equivalence Evaluations (Orange Book) Short Description. [cited 2018 December 4th]; https://www.fda.gov/Drugs/InformationOnDrugs/ApprovedDrugs/ucm626720.htm].
Por: Carolina Kawamura Haddad, Oncologista Clínica da BP – A Beneficência Portuguesa de São Paulo.

