Testagem para deficiência de enzimas do reparo (dMMR) em carcinomas endometriais no contexto da imunoterapia

A testagem molecular para investigar a presença de deficiência de enzimas do reparo (dMMR) em carcinomas endometriais têm ganhado importância devido às recentes aprovações de inibidores de checkpoint neste contexto. Neste texto, Dra. Aline do Nascimento, que é patologista no Instituto Nacional do Câncer (INCA) e Hospital São Vicente de Paulo do Rio de Janeiro, traz um compilado de estudos clínicos e apresenta a importância da análise patológica precisa dos tumores endometriais
As recentes aprovações de imunoterápicos no tratamento do câncer endometrial reforçam a necessidade da testagem molecular para investigar a presença de deficiência de enzimas do reparo (dMMR) em carcinomas endometriais. A testagem já é rotineiramente utilizada para o diagnóstico de síndrome de Lynch e aconselhamento genético, além de auxiliar no painel imuno-histoquímico de diagnóstico histopatológico em tumores de alto grau (endometrióide grau 3 versus seroso) e na classificação molecular prognóstica – introduzida pelo TCGA (The Cancer Genome Atlas). E agora, a testagem ganhou importância extra, a de selecionar grupos de pacientes para receber a imunoterapia.
Aproximadamente 20-30% de todos os carcinomas endometriais têm dMMR e a síndrome de Lynch é responsável por 5 a 6% de todos os tumores endometriais. Os genes de reparo do pareamento atuam restaurando a integridade do DNA após a ocorrência de erros do pareamento pontuais ou pequenas inserções ou deleções. Participam ativamente deste processo os quatro genes: MLH1, MSH2, MSH6 e PMS2. As quatro proteínas homônimas codificadas por esses genes funcionam em heterodímeros (MLH1-PMS2 e MSH2-MSH6). A ativação desses genes por mutação germinativa ou somática, ou mesmo por silenciamento epigenético, resulta na dMMR.
A dMMR leva à instabilidade microssatélite (MSI), que é caracterizada por grupos de mutações em microssatélites. O câncer endometrial com dMMR está associado a maior carga de antígenos e um maior infiltrado de linfócitos tumorais expressando CD3, CD8 e PD1, além de expressão de PD-L1 intraepitelial e em células imunes peritumorais quando comparado a neoplasia endometrial com estabilidade de microssatélite. No entanto, a elegibilidade para a imunoterapia no câncer endometrial baseia-se no status de dMMR/MSI e não na expressão de PD-L1.
A imuno-histoquímica (IHQ) é utilizada para testar a presença de dMMR. Existem vários kits comerciais disponíveis para as proteínas MLH1, MSH2, MSH6 e PMS2 e a interpretação do resultado é similar à descrita e utilizada nas neoplasias colorretais. Tumores com expressão de proteínas de reparo intactas exibem marcação nuclear em células tumorais com intensidade comparável ou mais forte que o controle interno, que são as células estromais endometriais ou núcleos de linfócitos. A perda de imunomarcação no núcleo das células tumorais na presença de controle interno indica dMMR (figura 1). Como as proteínas de reparo funcionam em dímeros, a perda de expressão de MLH1 resulta na perda de expressão de MLH1 e PMS2, assim como a perda de MSH2 resulta em perda de MSH2 e MSH6. Mutações em PMS2 e MSH6 normalmente não resultam em perda de MLH1 ou MSH2, respectivamente.
A interpretação da IHQ está sujeita a variáveis técnicas e pré-analíticas, como adequabilidade da amostra, fixação adequada do material e treinamento adequado de patologistas. Outros desafios estão relacionados a padrões de marcação aberrantes (citoplasmático, nucleolar e em pontos) que podem resultar de mutações focais/subclonais ou mesmo expressão mantida por proteína não funcional em mutações do tipo missense.
A testagem molecular tradicional por PCR (polymerase chain reaction) é usualmente indicada em casos de resultados indeterminados na imuno-histoquímica, incluindo discordância ou dificuldades de interpretação ou em casos de perda de apenas uma subunidade do heterodímero (por exemplo, apenas MLH1 ou apenas PMS2 e não os dois). Nesse tipo de teste, podem ser utilizados dois painéis de amplificação: um com repetições de cinco microssatélites (BAT-25, BAT-26, D5S346, D2S123 e D17S250) e outro usando repetições de cinco poly-A mononucleotídeos (BAT-25, BAT-26, NR-21, NR-24, NR-27); e a instabilidade microssatélite (MSI) é definida como a perda de estabilidade em 2 dos 5 marcadores de microssatélites. O sequenciamento de nova geração (NGS) pode ser, alternativamente, feito.
A testagem para dMMR nos ensaios clínicos de imunoterapia para câncer endometrial não é uniforme. No estudo clínico GARNET (dostarlimabe), as pacientes de todos os tipos histológicos, exceto sarcoma, foram testadas usando IHQ, PCR ou NGS em laboratórios locais. Entretanto, em maio de 2019 foi acrescentado no estudo que os pacientes deveriam ter IHQ para proteínas de MMR realizada em laboratórios locais, e era preferido quando o paciente tinha tanto IHQ e PCR. Já no KEYNOTE-158 (pembrolizumabe) as pacientes foram testadas por PCR em laboratório central na coorte de pacientes com câncer endometrial independente do status de MMR; e, na coorte de pacientes com MSI/dMMR, a testagem foi feita prospectivamente por PCR e/ou IHQ em laboratório local. Não há referência nesses artigos se houveram casos em que a interpretação da IHQ é biologicamente improvável (por exemplo MLH1 negativo e PMS2 positivo com MSH2 negativo e MSH6 positivo), já que os autores mencionam como dMMR apenas o critério de perda de expressão de um ou mais marcadores.
Embora a testagem por IHQ e PCR tenha acurácia semelhante e a IHQ é recomendada como teste inicial para detecção de dMMR pela ESMO (Sociedade Europeia de Oncologia Médica) em variadas neoplasias, não há padronização para a testagem no contexto da imunoterapia. O CAP (College of American Pathologists) lista uma proposta sobre esse assunto na seção de próximos guidelines. É necessário rever qual modalidade de teste seria melhor e quais dos métodos empregados conseguem melhor predizer o tratamento com inibidores de checkpoint.
Este é um aspecto especialmente sensível, pois há relatos na literatura de uma porcentagem inaceitável de pacientes inscritos em estudos clínicos (quase 10%) que avaliavam imunoterapia para câncer colorretal metastático que tiveram falha terapêutica por resultado falso positivo para dMME ou MSI-PCR, avaliados em laboratórios locais. A ESMO passou a recomendar IHQ e PCR para definição da elegibilidade para tratamento com inibidores de checkpoint em câncer colorretal metastático e outras neoplasias dentro do espectro da síndrome de Lynch.
Independente do teste utilizado, é necessário que haja padronização e, que preferencialmente, os ensaios clínicos utilizem IHQ, já que esta técnica tem grande acessibilidade e boa acurácia. Importante reforçar que é imprescindível que o material da paciente (biópsias, curetagens, peças cirúrgicas) seja conservado e analisado seguindo boas práticas clínicas.
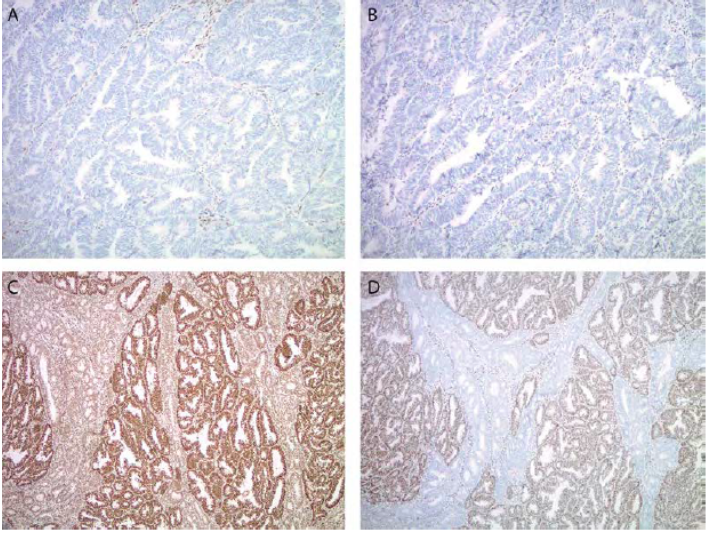
Figura 1 – IHQ para MMR. Perda de expressão de MLH1 (A) e PMS2 (B) com diminuição subclonal de MSH2 (C) e perda subclonal de MSH6(D) em adenocarcinoma endometrióide de endométrio. Adaptado de Buza, N (7).
Referências:
- O`Malley, D. Pembrolizumab in Patients With Microsatellite Instability–HighAdvanced Endometrial Cancer: Results From the KEYNOTE-158 Study. DOI: 10.1200/JCO.21.01874 Journal of Clinical Oncology 40, no. 7 (March 01, 2022) 752-761.
- Oaknin A, Gilbert L, Tinker AV, et al Safety and antitumor activity of dostarlimab in patients with advanced or recurrent DNA mismatch repair deficient/microsatellite instability-high (dMMR/MSI-H) or proficient/stable (MMRp/MSS) endometrial cancer: interim results from GARNET—a phase I, single-arm study Journal for ImmunoTherapy of Cancer 2022;10:e003777. doi: 10.1136/jitc-2021-003777.
- Cohen R, Hain E, Buhard O, Guilloux A, Bardier A, Kaci R, Bertheau P, Renaud F, Bibeau F, Fléjou JF, André T, Svrcek M, Duval A. Association of Primary Resistance to Immune Checkpoint Inhibitors in Metastatic.
- Luchini C, Bibeau F, Ligtenberg MJL, Singh N, Nottegar A, Bosse T, Miller R, Riaz N, Douillard JY, Andre F, Scarpa A. ESMO recommendations on microsatellite instability testing for immunotherapy in cancer, and its relationship with PD-1/PD-L1 expression and tumour mutational burden: a systematic review-based approach. Ann Oncol. 2019 Aug 1;30(8):1232-1243. doi: 10.1093/annonc/mdz116.
- Colorectal Cancer With Misdiagnosis of Microsatellite Instability or Mismatch Repair Deficiency Status. JAMA Oncol. 2019 Apr 1;5(4):551-555. doi: 10.1001/jamaoncol.2018.4942.
- Buza N. Immunohistochemistry in gynecologic carcinomas: Practical update with diagnostic and clinical considerations based on the 2020 WHO classification of tumors. Semin Diagn Pathol. 2022 Jan;39(1):58-77. doi: 10.1053/j.semdp.2021.10.006.
© 2020 Oncologia Brasil
A Oncologia Brasil é uma empresa do Grupo MDHealth. Não provemos prescrições, consultas ou conselhos médicos, assim como não realizamos diagnósticos ou
tratamentos.


 Vea MedIQ en Español
Vea MedIQ en Español