FDA aprova L-GLUTAMINA para redução das complicações agudas da Anemia Falciforme.
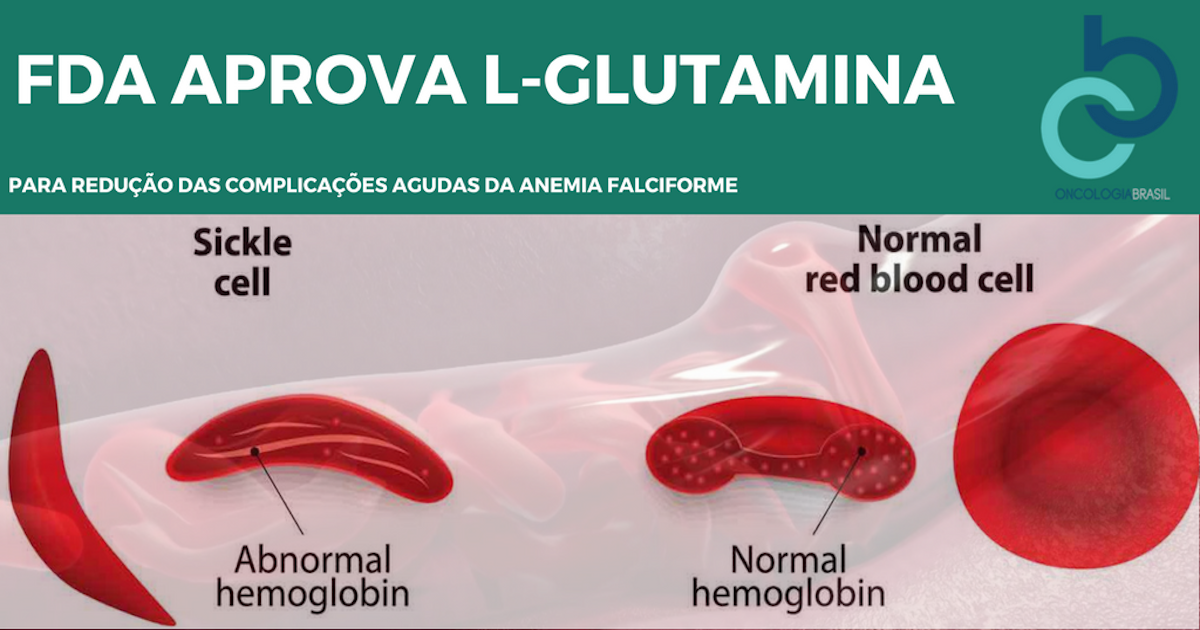
No Dia 7 de Julho FDA aprovou L-glutamina oral em pó (Endari, Emmaus Medical, Inc) para administração oral com indicação para redução das complicações agudas da Anemia Falciforme em pacientes adultos e pediátricos (>5 anos de idade).
A aprovação foi com base nos dados do estudo randomizado, duplo cego (NCT01179217) que incluiu 230 pacientes ( 5 a 58 anos de idade) com anemia falciforme ou talassemia que apresentaram 2 crises de dor no período de 12 meses antes da participação no Estudo. A eficácia foi demonstrada com a redução do número de crises até a Semana 48 comparando pacientes que receberam L-glutamina com pacientes no braço placebo. Os eventos adversos mais comuns >10% dos pacientes foram: constipação, náusea, cefaleia, dor abdominal, tosse, dor em extremidades, dor lombar e dor torácica. Descontinuação do tratamento devido a eventos adversos foram de 2.7% (n=5) pacientes.
A dose recomendada de L-glutamina é 10 – 30 gramas ao dia (baseada no peso), por via oral, duas vezes ao dia.
Por Carla Mazzuco: Enfermeira, MBA, especialista em Saúde Pública
© 2020 Oncologia Brasil
A Oncologia Brasil é uma empresa do Grupo MDHealth. Não provemos prescrições, consultas ou conselhos médicos, assim como não realizamos diagnósticos ou
tratamentos.


 Vea MedIQ en Español
Vea MedIQ en Español 




