DESTINY-Breast03: dados atualizados de sobrevida global de trastuzumabe deruxtecana versus trastuzumabe emtansina em pacientes com câncer de mama metastático HER2-positivo

A MDHealth e a Oncologia Brasil estão presencialmente em San Antonio, e trazem neste vídeo, Dra. Sara Hurvitz, professora de Medicina na David Geffen School of Medicine – UCLA, para falar sobre os dados atualizados – e já maduros, do DESTINY-Breast03.
Estes dados demonstram que o tratamento de segunda linha com trastuzumabe deruxtecana (T-DXd) levou a uma sobrevida global significativamente mais longa em comparação com trastuzumabe emtansina (T-DM1), em pacientes com câncer de mama metastático HER2-positivo. Confira o conteúdo completo!
Durante o The San Antonio Breast Cancer Symposium (SABCS) deste ano, foram apresentadas atualizações dos desfechos do estudo de fase III DESTINY-Breast 03. Este tem como objetivo comparar a atividade antitumoral, bem como a eficiência do trastuzumabe deruxtecana (T-DXd) versus trastuzumabe emtansina (T-DM1) em pacientes com câncer de mama HER2-positivo (HER2+), irressecável e/ou metastático, previamente tratados com trastuzumabe e taxano. Os dados apresentados relatam a análise de sobrevida global (SG) pré-especificada (corte de dados em 25 de julho de 2022), incluindo eficácia e segurança atualizadas.
Participaram do estudo 524 pacientes com câncer de mama metastático HER2+ previamente tratados com trastuzumabe e um taxano no cenário metastático ou no cenário (neo)adjuvante com progressão dentro de 6 meses de terapia, que poderiam ter recebido pertuzumabe. Os pacientes foram aleatoriamente designados 1:1 para receber T-DXd (n = 261) ou T-DM1 (n = 263), ambos por três semanas até a progressão da doença. O endpoint primário foi a sobrevida livre de progressão por revisão central independente cega (BICR). O endpoint secundário principal foi a SG (80% com nível de significância bilateral de 5%); outros parâmetros secundários incluíram taxa de resposta objetiva (ORR), duração da resposta (DoR) com base na avaliação do investigador e segurança.
No corte de dados atualizados, a duração mediana do acompanhamento do estudo foi de 28,4 meses (intervalo 0,0 – 46,9 meses) para T-DXd e 26,5 meses (intervalo 0,0 – 45,0 meses) para T-DM1. A duração mediana do tratamento foi de 18,2 meses (intervalo 0,7 – 44,0 meses) ou T-DXd e 6,9 meses (intervalo 0,7 – 39,3 meses) para T-DM1. O risco de morte foi reduzido em 36% (HR: 0,64; P = 0,0037) com T-DXd. Dos efeitos adversos relacionados com o tratamento (TEAEs), doença pulmonar intersticial/pneumonite relacionada aos fármacos, conforme avaliado por um comitê de adjudicação independente, ocorreu em 39 pacientes (15,2%) no braço T-DXd e 8 pacientes (3,1%) no braço T-DM1; não foram observados eventos de grau 4 ou 5 relacionados a medicamentos adjudicados em pacientes que receberam T-DXd. Os principais resultados dos endopoints primário e secundário, além de eficácia e segurança são mostrados na tabela abaixo.
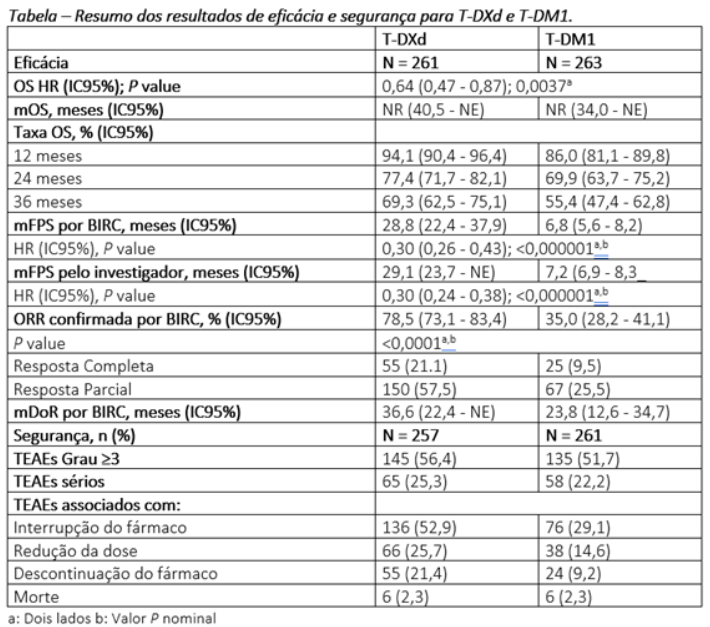
Os desfechos atualizados confirmam a superioridade de T-DXd em comparação a T-DM1 para pacientes com câncer de mama metastático HER2+ previamente tratados com uma terapia anti-HER2, com aumento clinicamente e estatisticamente significativo da sobrevida global e sobrevida livre de progressão, além do perfil de segurança gerenciável com maior duração do tratamento.
Referência:
1 – ABSTRACT GS2-02 – Sara A. Hurvitz, Trastuzumab deruxtecan versus trastuzumab emtansine in patients with HER2-positive metastatic breast cancer: Updated survival results of the randomized, phase 3 study DESTINY-Breast03. The San Antonio Breast Cancer Symposium – SABCS 2022.
© 2020 Oncologia Brasil
A Oncologia Brasil é uma empresa do Grupo MDHealth. Não provemos prescrições, consultas ou conselhos médicos, assim como não realizamos diagnósticos ou
tratamentos.


 Vea MedIQ en Español
Vea MedIQ en Español 




