Pembrolizumabe é aprovado pelo FDA para pacientes com carcinoma espinocelular cutâneo recorrente ou metastático
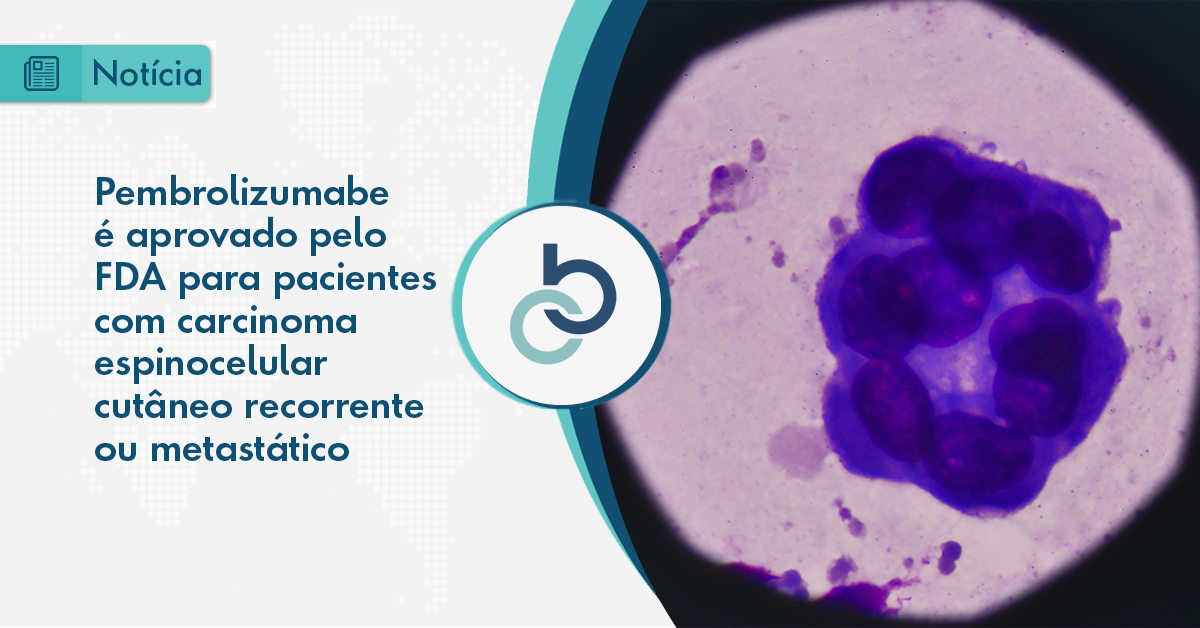
A aprovação aconteceu após estudo KEYNOTE-629 demonstrar que o pembrolizumabe resultou em respostas clinicamente significativas e duráveis, trazendo uma nova opção de tratamento para pacientes com este cenário
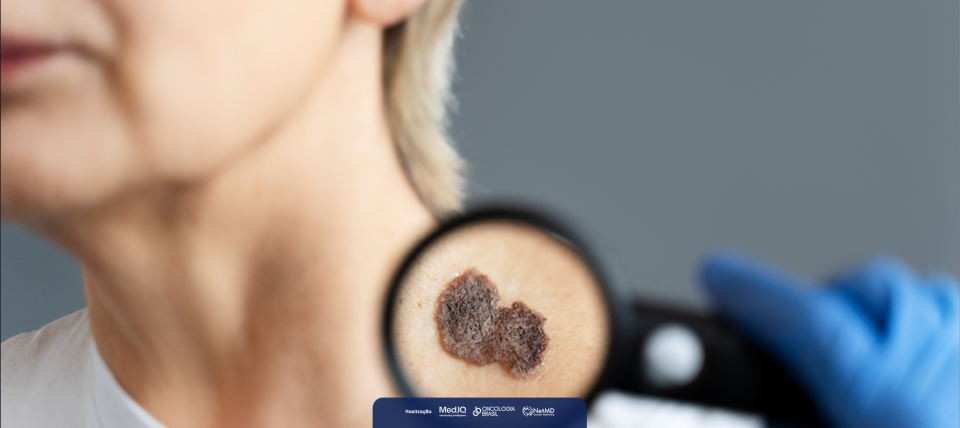
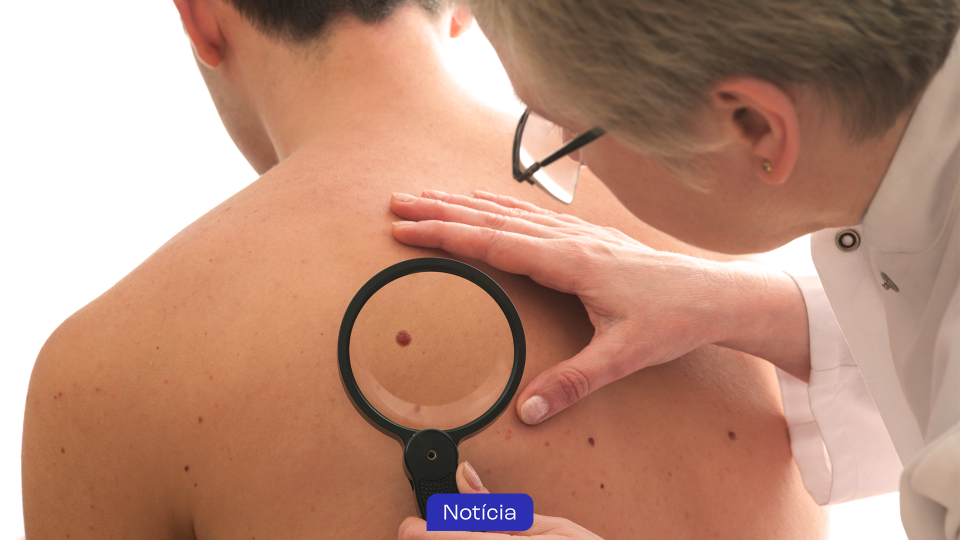
O pembrolizumabe foi recentemente aprovado nos Estados Unidos para pacientes com carcinoma espinocelular (CEC) cutâneo recorrente ou metastático não curáveis por cirurgia ou radioterapia. A doença é o segundo tipo mais comum de câncer de pele. A aprovação aconteceu após estudo KEYNOTE-629 demonstrar que o pembrolizumabe resultou em respostas clinicamente significativas e duráveis, trazendo uma nova opção de tratamento para pacientes com este cenário.
O KEYNOTE-629 (NCT03284424) – um estudo multicêntrico, de múltiplas coortes, não randomizado e aberto – excluiu pacientes que receberam terapia prévia com anti-PD-1, anti-PD-L1 ou anti-CTLA-4 e aqueles com doença autoimune ou qualquer condição médica que exigisse imunossupressão. Os pacientes receberam 200 mg de pembrolizumabe por via intravenosa a cada 3 semanas até a progressão da doença, toxicidade inaceitável ou no máximo 24 meses. A avaliação do status do tumor foi realizada a cada 6 semanas durante o primeiro ano e a cada 9 semanas durante o segundo ano.
As principais medidas de eficácia foram a taxa de resposta objetiva (TRO) e a duração da resposta, avaliadas pela revisão central independente cega de acordo com o RECIST 1.1, modificada para seguir um máximo de 10 lesões-alvo e um máximo de 5 lesões-alvo por órgão. A TRO foi de 34% (IC 95%: 24, 44) com uma taxa de resposta completa de 4% e uma taxa de resposta parcial de 31%. Após um tempo médio de acompanhamento de 9,5 meses, a duração mediana de resposta não foi alcançada (intervalo: 2,7 a 13,1 ou mais meses).
As reações adversas foram semelhantes às ocorridas em pacientes que receberam o pembrolizumabe como agente único em outros ensaios clínicos, ou seja, fadiga, dor musculoesquelética, diminuição do apetite, prurido, diarreia, náusea, erupção cutânea, pirexia, tosse, dispneia, constipação, dor e dor abdominal. O pembrolizumabe está associado a efeitos colaterais mediados pelo sistema imunológico, incluindo pneumonite, colite, hepatite, endocrinopatias, nefrite e reações adversas na pele.
A eficácia e a segurança do pembrolizumabe, usando uma dose de 400 mg a cada 6 semanas para o CEC cutâneo, foram baseadas principalmente na eficácia da dose/exposição e nas relações de segurança e dados farmacocinéticos observados em pacientes com melanoma.
Referências:
Grob JJ, Gonzalez R, Basset-Seguin N, Schachter J, Vornicova O, Bauman JR, Grange F, Meyer N, Piulats JM, Zhang E, Gumuscu B. KEYNOTE-629: Phase 2 study of pembrolizumab for recurrent/metastatic or locally advanced unresectable cutaneous squamous cell carcinoma (cSCC).
© 2020 Oncologia Brasil
A Oncologia Brasil é uma empresa do Grupo MDHealth. Não provemos prescrições, consultas ou conselhos médicos, assim como não realizamos diagnósticos ou
tratamentos.


 Vea MedIQ en Español
Vea MedIQ en Español