DESTINY-Lung02: trastuzumabe deruxtecana em pacientes com CPNPC metastático HER2 mutante
Desfechos do DESTINY-Lung02 demonstram a atividade clinicamente significativa trastuzumabe deruxtecana nas doses de 5,4 mg/kg e 6,4 mg/kg em pacientes com CPNPC HER2m previamente tratados, entretanto o perfil de segurança foi mais favorável com a menor dose.
Embora o direcionamento de HER2 tenha transformado o tratamento de pacientes com câncer de mama e gástrico, as terapias direcionadas a HER2 ainda não foram aprovadas para pacientes com câncer de pulmão não pequenas células (CPNPC). Atualmente, os pacientes com CPNPC com mutação em HER2 (HER2m) são tratados com quimioterapia ou imunoterapia padrão, que possuem atividade limitada como tratamento de segunda linha ou posterior.
Resultados do ensaio clínico de fase II DESTINY-Lung01 mostraram que a concentração de 6,4 mg/kg de trastuzumabe deruxtecana (T-DXd) mostrou atividade anticancerígena durável em pacientes com CPNPC HER2m previamente tratados. Dando continuidade a avaliação do T-DXd em CPNPC, o DESTINY-Lung02, um estudo de fase II multicêntrico, randomizado, de dois braços e não comparativo, avalia a segurança e eficácia de 5,4 mg/kg e 6,4 mg/kg de T-DXd administrado a cada 3 semanas (Q3W) em participantes com CPNPC metastático com HER2m previamente tratados.
Os pacientes foram randomizados 2:1 para T-DXd 5,4 ou 6,4 mg/kg Q3W, respectivamente. A coorte precoce pré-especificada (PEC; pacientes randomizados ≥ 4,5 meses antes do corte de dados) foi definida para incluir pacientes com avaliações tumorais pós-basais. O conjunto de análise de segurança (SAS) se refere a todos os pacientes randomizados que receberam ≥ 1 dose de T-DXd. O estudo não teve poder para comparar estatisticamente as doses.
Durante o Congresso ESMO 2022 foram apresentados os dados referentes ao desfecho primário (taxa de resposta objetiva confirmada – cORR) e os desfechos secundários (duração da resposta – DoR; taxa de controle de doença confirmada – cDCR e segurança) do DESTINY-Lung02.
Na data de corte (24/03/2022), 52 e 28 pacientes na coorte PEC foram randomizados e 101 e 50 pacientes do SAS foram tratados com T-DXd 5,4 ou 6,4 mg/kg, respectivamente. A duração mediana do acompanhamento foi de 5,6/5,4 meses e 3,8/3,9 meses. No PEC, o cORR foi de 53,8% (IC95% 39,5 – 67,8%) e 42,9% (IC95% 24,5 – 62,8%) em pacientes que receberam T-DXd 5,4 ou 6,4 mg/kg, respectivamente. Mais detalhes da taxa de resposta estão na tabela abaixo.
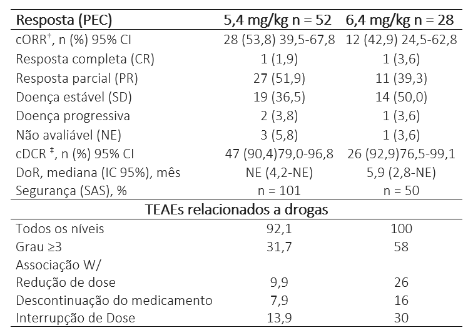
Os eventos adversos emergentes do tratamento (TEAEs) foram maiores com T-DXd 6,4 mg/kg vs 5,4 mg/kg no PEC e SAS (duração mediana do tratamento: 4,7/5,5 meses e 3,3/3,7 meses). No SAS, qualquer grau de doença pulmonar intersticial relacionada à droga adjudicada ocorreu em 5,9% e 14,0% dos pacientes que receberam T-DXd 5,4 ou 6,4 mg/kg, respectivamente.
Os autores concluem que o DESTINY-Lung02 demonstrou atividade clinicamente significativa com T-DXd 5,4 mg/kg e 6,4 mg/kg em pacientes com CPNPC HER2m previamente tratado na coorte PEC, com perfil de segurança mais favorável de T-DXd na dose de 5,4 mg/kg.
Referência:
1 – LBA55 – K. Goto, K. Sang-We et al. Trastuzumab deruxtecan (T-DXd) in patients (Pacientes) with HER2-mutant metastatic non-small cell lung cancer (NSCLC): Interim results from the phase 2 DESTINY-Lung02 trial. Annals of Oncology (2022) 33 (suppl_7): S808-S869. 10.1016/annonc/annonc1089. ESMO Annual World Congress – ESMO 2022
© 2020 Oncologia Brasil
A Oncologia Brasil é uma empresa do Grupo MDHealth. Não provemos prescrições, consultas ou conselhos médicos, assim como não realizamos diagnósticos ou
tratamentos.


 Vea MedIQ en Español
Vea MedIQ en Español 




