ANVISA aprova o uso de amivantamabe em pacientes com CPNPC com mutações de inserção no Exon 20 do EGFR após progressão a platina
Amivantamabe é o primeiro anticorpo biespecífico para pacientes que possuem câncer de pulmão não pequenas células com mutações de inserção no éxon 20 do EGFR
A partir de 20 de setembro de 2021, a ANVISA liberou o uso de amivantambe em monoterapia em pacientes com câncer de pulmão não pequena células (CPNPC) com mutações de inserção no exon 20 do EGFR (Exon20ins) após progressão à quimioterapia a base platina. A aprovação teve como base os dados do estudo CHRYSALIS, que mostram que o amivantamabe apresentou taxa de resposta objetiva de 40% em pacientes com CPNPC avançado com Exon20ins do EGFR após terapias de primeira linha.
As mutações ativadoras do EGFR representam os principais drivers CPNPC, sendo representadas em sua grande maioria (85%) pelas deleções do exon 19 e por mutações pontuais no exon 21 (L858R). As inserções no exon 20 (Exon20ins) aparecem em terceiro lugar nesse cenário (≤12%), sendo caracterizadas por inserções na sequência de leitura do DNA ou por duplicações próximas ao domínio de tirosina-quinase (TK), sendo mais de 100 variantes identificadas por sequenciamento de nova geração. Como consequência, ocorre um impedimento espacial no domínio de TK, o que resulta em baixas taxa de resposta (0-9%) mediante tratamento com os inibidores de TK (TKIs) aprovados para mutações do EGFR. Desta forma, no contexto de CPNPC com EGFR Exon20ins, o tratamento padrão é baseado em quimioterapia com platina, refletindo em mediana de sobrevida global (SG) de 16 meses (inferior a mediana de 39 meses nos pacientes com mutações sensíveis a TKIs do EGFR).
O amivantamabe é um anticorpo totalmente humanizado com afinidade ao domínio extracelular do EGFR e do MET. Decorrente dessa interação, há inibição da ativação dos receptores pelos respectivos ligantes, que leva a fagocitose das células por macrófagos e ataque citotóxico por linfócitos natural killers.
O estudo de multicêntrico de fase I CHRYSALIS (NCT02609776) foi desenhado em duas partes (I-escalonamento e II-expansão de dose), para avaliação do amivantamabe, como monoterapia ou em combinação com outras terapias, em pacientes com CPNPC avançados. Este estudo, publicado recentemente no Journal of Clinical Oncology, apresentou dados atualizados do uso de amivantamabe em monoterapia em pacientes com CPNPC com EGFR Exon20ins após progressão à quimioterapia a base platina (figura 1). Pacientes elegíveis teriam que ter diagnóstico histológico CPNCP metastático ou iressecável, ECOG ≤1, progressão de doença (ou inelegibilidade, ou recusar o tratamento) à esquemas de quimioterapia contendo platinas, doença mensurável pelo RECIST versão 1.1, presença de EGFR Exon20ins em amostra tecidual ou DNA tumoral circulante e doença controlada em sistema nervoso central. Os desfechos primários foram a incidência de toxicidade dose limitante (parte I de escalonamento de dose) e taxa de resposta objetiva (parte II de expansão de dose). Os desfechos secundários foram duração de resposta, taxa de benefício clínico, sobrevida livre de progressão (SLP) e SG. O tratamento seria continuado até progressão de doença, toxicidade inaceitável ou retirada do consentimento do estudo. Os resultados foram liberados após um mínimo de 80 pacientes incluídos na fase de expansão.
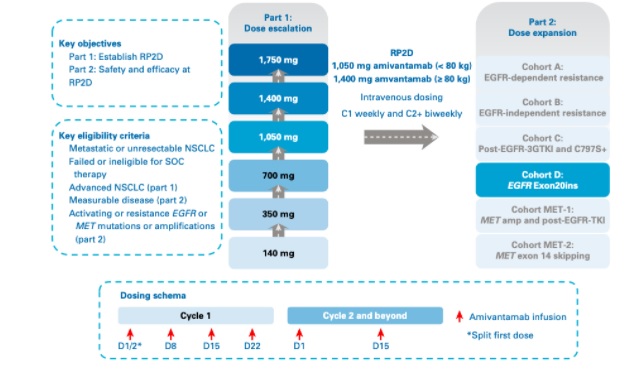
Figura 1. Desenho do estudo CHRYSALIS. Pacientes com CNPNC avançados foram incluídos em coortes de escalonamento de dose e de expansão.
Resultados:
De 27 de maio de 2016 a 8 junho de 2020, 362 pacientes foram incluídos no estudo. Destes, 77 participaram da fase de escalonamento, e um total de 258 estavam envolvidos entre as duas fases (escalonamento e expansão), sendo estes tratados com RP2D (dose recomendada para fase II) de 1.050mg de amivantamabe (1.400mg se ≥80kg) uma vez por semana nas primeiras 4 semanas seguidos de 1 aplicação a cada 2 semanas. Na população para análise de eficácia (N=81), 59% (48) eram mulheres, 49% (40) asiáticos, 53% (43) não fumantes, 95% (77) adenocarcinomas, mediana de linhas de tratamento de 2 (1-7), todos tinham recebido quimioterapia prévia com platina, 46% (37) receberam imunoterapia prévia e 25% foram tratados com algum TKI. A mediana de segmento nessa população foi de 9.7 meses (1.1-29.3 meses).
A taxa de resposta objetiva foi de 40% (95% IC, 29-51), 4% (3) com resposta completa e 36% (29) com resposta parcial. A mediana de duração de resposta foi de 11.1 meses (95% IC, 6.9 – não atingido). Atividade antitumoral foi observada entre todas as populações pré-especificadas. Dentre os 63 pacientes com DNA circulante tumoral identificado por sequenciamento de nova geração, foram encontradas 25 mutações Exon20ins distintas. Atividade antitumoral foi observada em pacientes com inserções nas regiões helicoidais, próximo a alça, e também distantes da alça do exon 20. A mediana de SLP foi de 8.3 meses (95% IC, 6.5 – 10.9 meses). A mediana de SG foi de 22.8 meses (95% IC, 14.6 – não atingido). Entretanto, apesar de 23 mortes, este desfecho primário ainda permanece imaturo.
O perfil de segurança da população EGFR Exon20ins foi consistente com a inibição do EGFR e do MET. Os eventos adversos associados com a inibição do EGFR incluíram rash em 98 pacientes (86%), paroníquia em 51 (45%), estomatite em 24 (21%), prurido em 19 (17%) e diarreia em 14 (12%). Já os efeitos colaterais relacionados à inibição do MET foram hipoalbuminemia e edema periférico em 31 (27%) e em 21 (18%) dos pacientes respectivamente. Doença intersticial pulmonar foi encontrada em 5 pacientes (4%). Reações infusionais foram observadas em 75 (66%) pacientes, ocorrendo predominantemente no primeiro dia do ciclo 1 (93%). 40 pacientes (35%) apresentaram eventos adversos ≥ grau 3, mais frequentemente representados por hipocalemia (5%), rash, embolia pulmonar, diarreia e neutropenia (4% em cada). Redução de dose ocorreu em 15 pacientes (13%). 5 pacientes (%) necessitaram de descontinuação de tratamento. Não houve relato de efeitos colaterais grau 5.
Conclusão:
De acordo com os dados apresentados, pode-se concluir que amivantamabe é o primeiro anticorpo bioespecífico a demonstrar atividade clínica em pacientes com CPNPC com Exon20ins, além de apresentar perfil favorável de toxicidade.
Referências:
- KeunchilPark, et al., Amivantamab in EGFR Exon 20 Insertion–Mutated Non–Small-Cell Lung Cancer Progressing on Platinum Chemotherapy: Initial Results From the CHRYSALIS Phase I Study. DOI: 10.1200/JCO.21.00662 Journal of Clinical Oncology. Published online August 02, 2021.
Apoio Educacional:

Para saber mais sobre câncer de pulmão acesse: https://canceregfr.com



